
體外哺乳類細胞基因突變(HGPRT)試驗原理及注意事項
In vitro Mammalian Cell Gene Mutation Test
【試驗原理】
體外哺乳動物細胞基因突變試驗是利用培養的哺乳動物細胞作指示生物的體外遺傳毒理學試驗,可用于檢測有化學物質誘導的基因突變,適用的細胞系包括小鼠淋巴瘤細胞(L5178Y),中國倉鼠肺細胞(V79),中國倉鼠卵巢細胞(CHO),人類淋巴母細胞(TK6)等。這些細胞系,常用的遺傳學終點是檢測胸苷激酶(TK)圖標,次黃嘌呤鳥嘌呤轉磷酸核糖激酶(HPRT/HGPRT)圖標,黃嘌呤轉磷酸核糖激酶(XPRT)基因突變。TK、HPRT/HGPRT、XPRT突變試驗可以檢測不同的遺傳事件譜。
細胞在正常情況下,能產生HGPRT(次黃嘌呤鳥嘌呤磷酸核糖轉移酶),在含有6-硫代鳥嘌呤(6-thioguanine,6-TG)的選擇性培養液中,HGPRT催化產生核苷-5,-單磷酸(NMP),NMP摻入DNA中致細胞死亡。在致癌和(或)致突變物作用下,某些細胞X染色體上控制HGPRT的結構基因發生突變,不能再產生HGPRT, 從而使突變細胞對6-TG具有抗性作用,能夠在含有6-TG的選擇性培養液中存活生長。在有或無代謝活化系統的條件下,將細胞培養物暴露于受試物中適當時間,然后將細胞再傳代培養,在含有6-TG的選擇性培養液中,突變細胞會繼續分裂并形成集落,計數突變集落形成數,計算突變頻率,從而推斷受試物的致突變性。
【參考標準】
GB 15193.12-2014 體外哺乳類細胞HGPRT基因突變試驗
【材料和試劑】
細胞:常用中國倉鼠肺細胞株(V79)和中國倉鼠卵巢細胞株(CHO),其他如小鼠淋巴瘤細胞株(L5178Y)和人類淋巴母細胞株(TK6)亦可。細胞在使用前應進行有無支原體污染的檢查。
培養液:應根據試驗所用系統和細胞類型來選擇適宜的培養基。對于 V79和 CHO 細胞,常用-低必需培養基(MEM,Eagle)、改良 Eagle培養基(DMEM)加人10%胎牛血清和適量抗菌素。對于 TK6 和 L5178Y細胞,常用 RPMI 1640培養液,加人10%馬血清(培養瓶培養)或20%馬血清(96孔板培養)和適量抗菌素(青霉素、鏈霉素)。
胰蛋白酶/EDTA溶液:用無鈣、鎂 PBS配制,胰酶的濃度為0.05 %,EDTA 的濃度為0.02% ,胰蛋白酶與EDTA溶液按1:1混合。-20℃儲存。
活化系統:通常使用的是S9混合物。
選擇劑:6-硫代鳥嘌呤(6-TG),建議使用終濃度為5μg/mL~15μg/mL,用碳酸氫鈉溶液(0.5 %)配制。
預處理培養液(THMG/THG):為減少細胞的自發突變頻率,在試驗前,先將細胞加在含 THMG的培養液中培養24h,清除自發的突變細胞,然后再將細胞接種于THG(不含氨甲喋呤的THMG培養液)中培養1d~3d至細胞恢復正常生長周期和形態。
THMG 所含各物質終濃度如下(除培養液成分外):
————胸苷,5×10-6 mol/L;
————次黃嘌呤,5×10-5 mol/L;
————氨甲喋呤,4×10-7 mol/L;
————甘氨酸,1×10-4 mol/L;
【試驗方法】
一、受試物
受試物配制:固體受試物應溶解或懸浮于適合的溶媒中,并稀釋至適當濃度。液體受試物可直接使用或稀釋至適當濃度。受試物應在使用前現用現配,否則就必須證實貯存不影響其穩定性。
溶媒的選擇:溶媒必須是非致突變物,不與受試物發生化學反應,不影響細胞存活和S9活性。首-選溶媒是蒸餾水;對于不溶于水的受試物可選擇其他溶媒,首-選二甲基亞礬(DMSO),但使用時濃度不應大于0.5%。
對照:
每一項試驗中,在有無代謝活化系統條件下均應設陽性和陰性(溶媒)對照組。
二、劑量
-高濃度選擇:決定-高濃度的因素是細胞毒性、受試物在試驗系統中的溶解度以及pH 或滲透壓的改變。
細胞毒性確定:應使用指示細胞完整性和生長情況的指標,在代謝活化系統存在和不存在兩種條件下確定細胞毒性,例如相對集落形成率或相對存活率。應在預試驗中確定細胞毒性和溶解度。
濃度設置和-高濃度選擇:至少應設置4個可供分析的濃度。當有細胞毒性時,其濃度范圍應包括從大毒性至幾乎無毒性,通常濃度間隔系數在2~√10之間;如-高濃度是基于細胞毒性,那么該濃度組的細胞相對集落形成率或相對存活率應為 10%~20 %(不低于10% )。對于那些細胞毒性很低的化合物,-高濃度應是5μL/mL、5mg/mL或0.01mol/L。對于相對不溶解的物質,其-高濃度應達到或超過在細胞培養狀態下的溶解度限值;-好在試驗處理開始和結束時均評價溶解度,因為由于S9等的存在,試驗系統內在暴露過程中溶解度可能發生變化,不溶解性可用肉眼鑒別,但沉淀不應影響觀察。
三、試驗步驟和觀察指標
貼壁生長細胞的試驗步驟和觀察指標:
懸浮生長細胞的試驗步驟和觀察指標:
【數據處理和結果評價】
貼壁生長細胞 HGPRT試驗數據處理:
細胞毒性:以相對于溶媒對照組的集落形成率表示細胞毒性。即以溶媒對照的集落形成率為100%(1.00),求出各受試物組的相對值。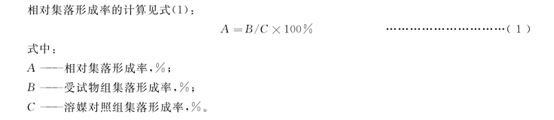

懸浮生長細胞 HGPRT試驗數據處理:
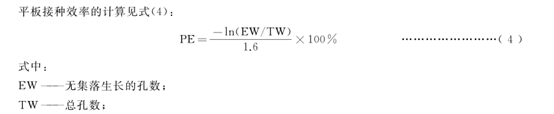


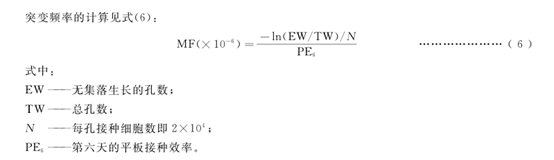
受試物組在任何一個劑量條件下的突變頻率為陰性(溶媒)對照組的3倍或3倍以上,可判定為陽性。
受試物組的突變頻率增加,與陰性(溶媒)對照組比較具有統計學意義,并有劑量-反應趨勢,則可判定為陽性。
受試物組在任何一個劑量條件下引起具有統計學意義的增加并有可重復性,則可判定為陽性。
不符合上述陽性結果判定標準,則可判定為陰性。
【試驗報告】
結論:本試驗條件下受試物是否具有致突變作用。
【試驗解釋】
若陰性對照中,集落形成率或存活率低于50%,結果應不采用。各實驗室選用的陽性對照突變頻率有一定范圍,若受試物的結果為陰性或弱陽性時,陽性對照的誘變率應達正常值的下限以上,否則結果不能成立。
HGPRT基因突變試劑盒
北京匯智泰康針對體外哺乳類細胞HGPRT基因突變試驗開發HGPRT基因突變試劑盒,試劑盒提供了進行體外哺乳類細胞HGPRT基因突變試驗所需的主要試劑和細胞(V79),可用于評價受試物的致突變作用。所用細胞和試劑均符合國標GB 15193.12-2014 《食品安全-國家標準 體外哺乳類細胞HGPRT基因突變試驗》的要求。
20mL×24體系/盒,4個劑量組。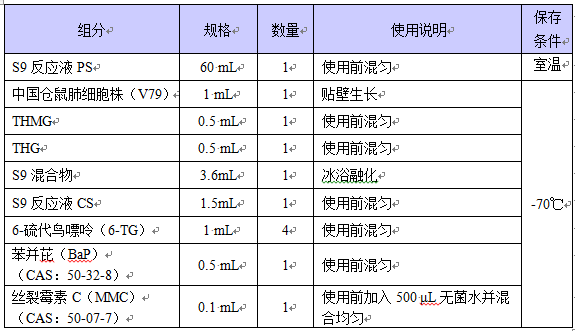
【產品使用說明】
1、細胞復蘇
收到試劑盒后,請盡快復蘇細胞。
從-70℃冰箱中取出細胞,于37℃水浴融化,離心,棄上清,用含10%胎牛血清(FBS)的RPMI-1640培養基重懸;再次離心,棄上清,用10% FBS培養基,接種于細胞培養瓶中,放置于37℃的二氧化碳培養箱中培養,后期細胞傳代比例為1:3。
2、自發突變細胞清除
取對數生長期細胞懸液,于含1% (V/V)的THMG的培養液中培養24 h,離心,洗滌后將細胞接種于含1% (V/V)的THG(不含氨甲喋呤)培養液中繼續培養1d~3d,至細胞恢復正常生長周期和形態。
注:為確保試驗的可行性,試驗中所用細胞的自發突變率應在5×10-6~20×10-6之間,清除自發突變的細胞傳代使用不得超過1個月,且每次試驗前需將細胞清除自發突變。
3、染毒處理
將5×105個細胞接種于直徑為100mm的平皿中,于37℃,5%二氧化碳培養箱中放置培養24h。吸去培養液,PBS洗兩次,加入一定量的無血清培養液、一定濃度的受試物及10%S9混合液(無需代謝活化者用無血清培養液或S9反應液PS補足),置于37℃,5%二氧化碳培養箱中培養3~6h,結束后吸去含受試物的培養液,用PBS洗細胞兩次,換入含10%血清的培養液,繼續培養19~22h,每個試驗組平行處理兩份培養物。
(1)S9混合液及染毒用細胞液配制
注:在試驗過程中,需根據實際需求,調整配制量。
(2)推薦染毒培養體系配制方案(試劑盒僅提供1次完整實驗的4個劑量組所需)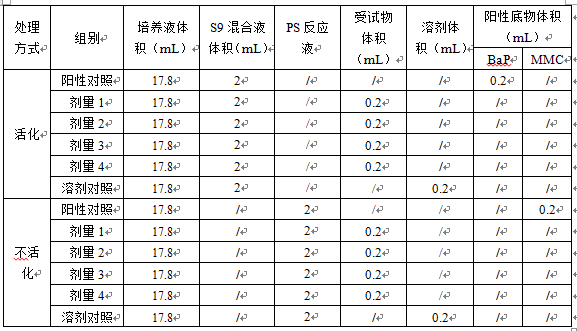
注:1.染毒時間可根據實際情況進行調整,一般為3h~6h,必要時可延長到1個或多個細胞周期。
2.如進行短時間染毒,可直接加入稀釋并混合均勻的絲裂-霉素C;若進行24h染毒,則需將絲裂-霉素C再稀釋2.5倍后再加入。
4、表達培養
接觸受試物的細胞繼續培養19~22h后,用胰酶-EDTA消化,待細胞脫落后,加入含10%血清的培養液終止消化,混勻,放入離心管中800r/min~1000r/min的速度離心5~7min,棄上清液,制成細胞懸液,計數,以5×105個接種于直徑為100mm的平皿,3d后傳代,仍接種5×105個細胞培養3d(-佳表達時間為6d~8d)。
5、細胞毒性測定
將上述*消化計數后的細胞每皿接種200個,每組5個皿,37℃、5%的二氧化碳條件下培養7d,固定,Giemsa染色,計數每皿集落數。
以相對于溶媒對照組的集落形成率表示細胞毒性,即以溶媒對照的集落形成率為100%,求出各受試物組的相對值。計算公式見(1):
A=B/C×100%------------------------------------------(1)
式中:A—相對集落形成率,%;B—受試物組集落形成率,%;C—溶媒對照組集落形成率,%。
6、突變體的選擇和集落形成率的測定
表達培養結束后,消化細胞,分種,每組5個皿,每皿接種200個細胞,不加6-TG,7d后固定,Giemsa染色,統計每皿集落數,計算集落形成率。同時另做突變頻率測定,每組5個皿,每皿接種2×105個細胞,待細胞貼壁后,按照千分之一的比例加入6-TG,放入培養箱中培養8~10d后固定,Giemsa染色,統計每皿集落數,計算突變頻率。
集落形成率計算見式(2):
D=E/F×100%-------------------------------------------(2)
式中:D—集落形成率,%;E—實際存活的細胞集落數;F—接種細胞數。
突變頻率計算見式(3):
式中:G—突變頻率;H—突變集落數;I—接種細胞數;D—集落形成率。
7、結果評價
7.1 實驗成立條件
若陰性對照中,集落形成率低于50%,結果應不予采用。
若受試物的結果為陰性或弱陽性時,陽性對照的誘變率應達正常值的下線以上,否則結果不成立。
7.2 結果判定
受試物組在任何一個劑量下的突變頻率為陰性(溶媒)對照組的3倍或3倍以上,可判定為陽性。
受試物組的突變頻率增加,與陰性(溶媒)對照組比較具有統計學意義,并有劑量-反應趨勢,則可判定為陽性。
受試物組在任何一個劑量條件下引起具有統計學意義的增加并有可重復性,則可判定為陽性。
不符合上述陽性結果判定標準,則可判定為陰性。
【注意事項】
實驗前請自行準備胎牛血清、RPMI1640基礎培養液、胰酶-EDTA、Giemsa染色液、100mm平皿、滅菌槍頭、無菌移液管、二氧化碳培養箱、振蕩器、50mL離心管等,所有耗材需做無菌處理。
電話
微信掃一掃
